Die weltweit rasant wachsende Zahl an Bakterienstämmen, denen Antibiotika nichts mehr anhaben können, stellt Medizin und Forschung vor große Herausforderungen. Einer Lösung ist Ao.Univ.-Prof. Dr. Ellen Zechner vom Institut für Molekulare Biowissenschaften der Uni Graz einen großen Schritt näher gekommen. Sie hat mit ihrer Arbeitsgruppe und KooperationspartnerInnen in London die Struktur des Enzyms Relaxase entschlüsselt, das mithilft, DNA zwischen Bakterien auszutauschen. Durch diesen Vorgang können ganze Populationen von Krankheitserregern binnen kürzester Zeit gegen verschiedene Antibiotika resistent werden. Die neuesten Erkenntnisse zu Aufbau, Arbeitsweise und Eigenschaften des Enzyms wurden in der aktuellen Ausgabe des Fachmagazins Cell publiziert.
Dass Bakterien grundsätzlich Erbinformationen austauschen können, ist bereits seit den 1950er-Jahren bekannt. „Trotz intensiver Forschung ist es uns erst jetzt gelungen, die Struktur des dafür verantwortlichen Schlüsselenzyms zu bestimmen“, unterstreicht Zechner die Bedeutung der bahnbrechenden Entdeckung. Dadurch können erstmals entscheidende Vorgänge während der Weitergabe von DNA erklärt werden. Das liefert völlig neue Anhaltspunkte, um die Relaxase auszuschalten und damit die Verbreitung von Antibiotika-Resistenzen einzudämmen. „Unsere Erkenntnisse könnten dazu beitragen, neue Wirkstoffe zu entwickeln, die den Austausch von Genen zwischen Bakterien unterbinden. Bisherige Versuche waren unter anderem deswegen nur mäßig erfolgreich, weil wir kein detailliertes Bild des Enzyms hatten“, schildert die Molekularbiologin.
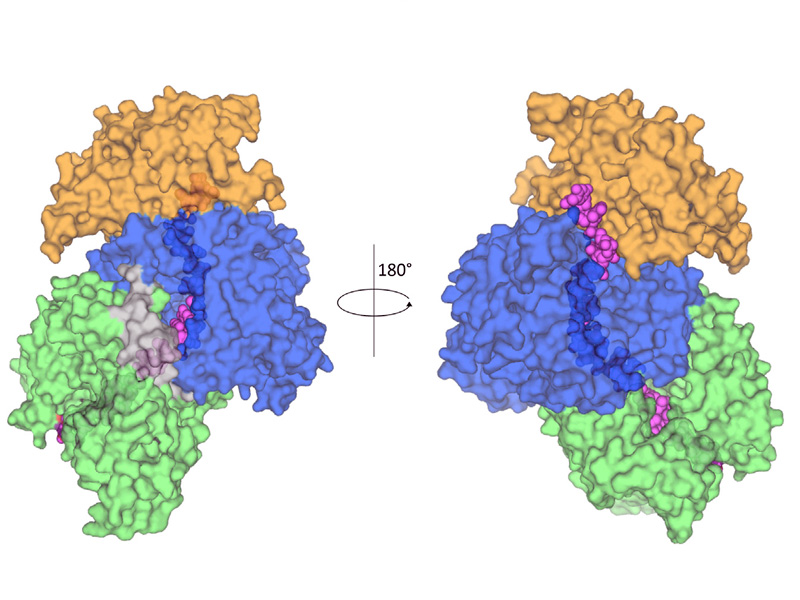
Die Relaxase wählt gezielt Erbinformationen aus, durchtrennt die beiden DNA-Stränge und transportiert einen davon durch einen Tunnel in das Nachbarbakterium. Der jeweils fehlende Strang wird in kürzester Zeit wieder nachgebildet. Die so übertragene Immunität gegen bestimmte Medikamente kann nun von beiden Bakterien wiederum weitergegeben werden. „Binnen Minuten werden große Mengen an DNA übertragen. Das erklärt, warum sich Antibiotikaresistenzen derart rasant ausbreiten“, schildert Zechner.
An der Erforschung des Enzyms war im Rahmen von BioTechMed-Graz auch Dr. Sandro Roier vom Institut für Molekulare Biowissenschaften der Uni Graz beteiligt. Zur Entschlüsselung der Struktur hat Prof. Gabriel Waksman vom University College London maßgeblich beigetragen.
Publikation:
Aravindan Ilangovan, Christopher W.M. Kay, Sandro Roier, Hassane El Mkami, Enrico Salvadori, Ellen L. Zechner, Giulia Zanetti, Gabriel Waksman: „Cryo-EM Structure of a Relaxase Reveals the Molecular Basis of DNA Unwinding during Bacterial Conjugation“, Cell 169, 1-14
Friday, 05 May 2017